Práctica No.9. LA CONSTANTE DE EQUILIBRIO PARA LA DISOCIACIÓN DE UN ÁCIDO DÉBIL EN SOLUCIÓN AMORTIGUADORA.
Práctica No. 9
LA CONSTANTE DE EQUILIBRIO PARA LA DISOCIACIÓN DE UN ÁCIDO DÉBIL EN SOLUCIÓN AMORTIGUADORA
OBJETIVO
Determinar experimentalmente la constante de equilibrio, Ka para la disociación de un ácido débil, en solución amortiguadora.
Una reacción reversible puede proceder tanto hacia adelante como hacia atrás. En teoría, la mayoría de las reacciones son reversibles en un sistema cerrado, aunque algunas pueden ser consideradas irreversibles si la formación de productos o reactivos se ve mayormente favorecida. La doble flecha incompleta que usamos al escribir reacciones reversibles, ⇋, es un buen recordatorio visual de que las reacciones pueden ir ya sea hacia adelante para generar productos, o hacia atrás para crear reactivos.
De acuerdo con las concentraciones de todas las especies de reacción en equilibrio, podemos definir una cantidad llamada la constante de equilibrio Kc, que a veces también se escribe como Keq o K. La c en el subíndice significa concentración, dado que la constante de equilibrio describe las concentraciones molares, en moles/l, en el equilibrio para una temperatura específica. La constante de equilibrio nos ayuda a entender si una reacción tiende a mostrar una concentración más alta de productos o de reactivos en el equilibrio. También podemos usar Kc para determinar si la reacción se encuentra o no en el equilibrio.
Tomado de: https://es.khanacademy.org/
ÁCIDO DÉBIL
Definición de ácido débil
Un ácido débil es un ácido que se disocia parcialmente en sus iones en una solución acuosa o agua. Por el contrario, un ácido fuerte se disocia completamente en sus iones en agua. La base conjugada de un ácido débil es una base débil, mientras que el ácido conjugado de una base débil es un ácido débil. En la misma concentración, los ácidos débiles tienen un valor de pH más alto que los ácidos fuertes.
El ácido acético, que se encuentra en el vinagre, es un ejemplo de un ácido débil.
¿Por qué los ácidos débiles son débiles?
Si un ácido se ioniza completamente en el agua depende de la polaridad o distribución de los electrones en un enlace químico. Cuando dos átomos en un enlace tienen casi los mismos valores de electronegatividad , los electrones se comparten de manera uniforme y pasan la misma cantidad de tiempo asociado con cualquier átomo (un enlace no polar).}
Por otro lado, cuando hay una diferencia de electronegatividad significativa entre los átomos, hay una separación de carga, donde los electrones se atraen más a un átomo que al otro (enlace polar o enlace iónico). Los átomos de hidrógeno tienen una ligera carga positiva cuando se unen a un elemento electronegativo. Si hay menos densidad de electrones asociada con el hidrógeno, se vuelve más fácil de ionizar y la molécula se vuelve más ácida. Los ácidos débiles se forman cuando no hay suficiente polaridad entre el átomo de hidrógeno y el otro átomo en el enlace para permitir la fácil eliminación del ion hidrógeno.
Otro factor que afecta la fuerza de un ácido es el tamaño del átomo unido al hidrógeno. A medida que aumenta el tamaño del átomo, la fuerza del enlace entre los dos átomos disminuye. Esto hace que sea más fácil romper el enlace para liberar el hidrógeno y aumenta la fuerza del ácido.
Tomado de: https://www.thoughtco.com/definition-of-weak-acid-604687


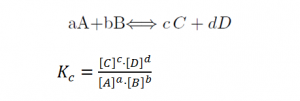



Comentarios recientes