Práctica N° 12: INDICADORES Y ESCALA DE PH – EXTRACTO DE REPOLLO COMO INDICADOR DE pH NATURAL
El pH es la medida del potencial de iones hidronio o hidrogenión o hidrón que tiene una sustancia o una solución. El pH interfiere en la cinética de las reacciones bioquímicas que se producen en nuestro organismo. Así mismo, controla muchas reacciones que involucran la preservación de especies y equilibrio entre los ecosistemas.
La determinación electrométrica de la concentración de hidrogeniones fue descubierta por Wilhelm Ostwald en Leipzig, Alemania, cerca de 1890 y fue descrita termodinámicamente por su estudiante Walther Nernst usando el concepto de presión osmótica y van’t Hoff y la teoría de Arrhenius de la ionización de los ácidos. Posteriormente, Hasselbach pudo determinar la concentración de estos iones en la sangre, con base en la ecuación de Henderson del ácido carbónico, usando un electrodo de hidrógeno y adaptando la escala de potencial de hidrógeno, que en 1909 el danés Søren Peter Lauritz Sørensen ya había descrito cómo el logaritmo negativo de la concentración de hidrogeniones.
La escala de pH típicamente va de 0 a 14 en disolución acuosa, siendo ácidas las disoluciones con pH < 7, alcalinas las que tienen pH > 7 y aquellas que presentan pH = 7 indica la neutralidad de la disolución (cuando el disolvente es agua).
Un indicador de pH es una sustancia que varía de color debido a un cambio estructural inducido por la protonación o desprotonación de la especie. Los indicadores Ácido-base tienen un intervalo de viraje de unas dos unidades de pH (Tabla 8). El indicador sufre una reacción reversible de disociación de un ácido débil, HIn (In: indicador):
HIn ↔ H+ + In–
Indicadores de fuentes naturales
El repollo morado (Brassica oleracea var. Capitata f. rubra) es una variedad de col en la que las hojas son color violáceo característico debido a la presencia de antocianinas como la cianina. La intensidad de este color depende en gran medida de la acidez (pH) del suelo; las hojas crecen más rojas en suelos de carácter ácido mientras que en los alcalinos son más azules. El colorante del repollo es un ácido débil, que vira de color, cuando se somete a reacciones ácido –base adquiriendo diferentes configuraciones estructurales dependiendo del medio en dónde se encuentre (Figura 1). La variación del color de las antocianinas en función del pH se resume en la tabla 1.
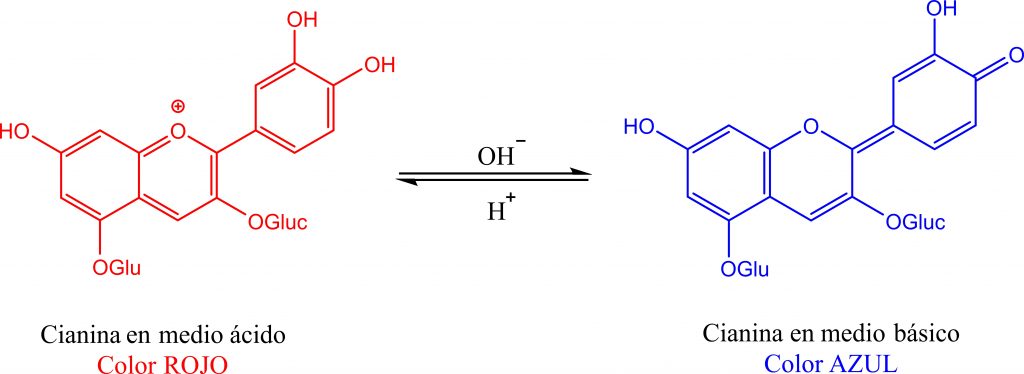
| pH | < 2 | 4 | 6 | 7 | 7.5 | 9 | 10 | 12 | >13 |
| Color | Rojo | Rojo – violeta | Violeta | Azul – violeta | Azul | Azul – verde | Verde – azulado | Verde | Amarillo |
Indicador de pH de Col Lombarda – Cienciabit
https://www.youtube.com/watch?v=94RlLZdh2Rk
La cúrcuma (Cúrcuma longa) es una planta herbácea originaria de la India, utilizada como condimento, tinte y en la medicina tradicional. Las raíces de cúrcuma producen curcumina, compuesto responsable por su coloración amarilla intensa. Éste compuesto puede ser extraído a partir de cúrcuma en polvo, comercializada como condimento o, a partir de curry, debido que contiene alto porcentaje de cúrcuma.
En medio básico (pH 8 – 9) la curcumina puede perder un hidrógeno de cualquiera de los dos grupos –OH o perder el H situado entre las dos cetonas (Figura 2). En la tabla 2 se indica la variación de color de la curcumina en función del pH .
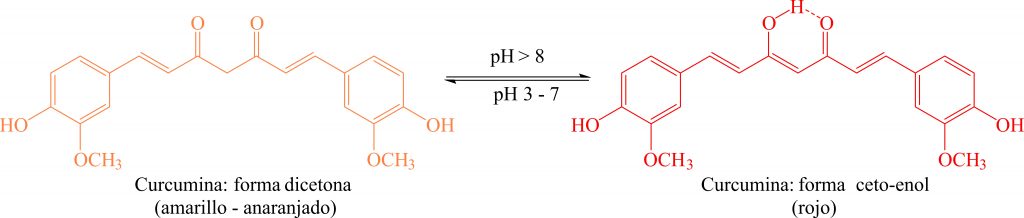
| pH | <6 | 6 – 9 | >9 |
| Color | Amarillo | Naranja | Rojo |




Comentarios recientes