Práctica No.16. Titulación de un ácido poliprótico.
Práctica No. 16
Titulación de un ácido poliprótico
OBJETIVOS
- Verificar y explicar la reacción de una base débil con un ácido fuerte, teniendo en cuenta curva de titulación con datos experimentales.
- Comparar pH teóricos con pH experimentales.
INTRODUCCIÓN
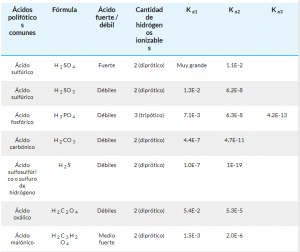
Los ácidos polipróticos son ácidos específicos que son capaces de perder más de un protón por molécula en reacciones ácido-base. (En otras palabras, ácidos que tienen más de un átomo de H + ionizable por molécula). Los protones se pierden a través de varias etapas (una en cada etapa), siendo el primer protón el más rápido y el más fácil de perder.
Constante de ionización
Es importante saber que K 1 > K 2 > K 3 , donde K representa la constante de acidez o la constante de ionización ácida(primero, segundo y tercero, respectivamente). Estas constantes se usan para medir el grado de disociación de hidrógenos en el ácido.
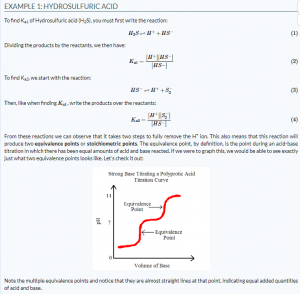
A continuación se muestra un ejemplo del tema tratado:
Notas:
En valoraciones de ácido fuerte + base fuerte, el pH cambia lentamente al principio, rápidamente a través del punto de equivalencia de pH = 7, y luego vuelve a disminuir. Si se valora en un ácido fuerte, el pH aumentará a medida que se agregue la base. Por el contrario, si está en una base fuerte, el pH disminuirá a medida que se agregue el ácido.
- En titulaciones de ácido fuerte + base débil, el pH cambia lentamente en el punto de equivalencia y el pH es igual al pK a del ácido. El pH está por debajo de 7.
- Para el ácido débil + base fuerte, el pH está por encima de 7 en el punto de equivalencia.
- Si queda un ácido fuerte o una base fuerte después del punto de equivalencia, se puede usar para encontrar el pH de la solución.
Tomado de: https://chem.libretexts.org/Textbook_Maps/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Acids_and_Bases/Monoprotic_Versus_Polyprotic_Acids_And_Bases/Polyprotic_Acids_And_Bases
Simulación:
http://wps.prenhall.com/wps/media/objects/4679/4792059/ch16_09.htm





Comentarios recientes